aminosäuren können zugesetzte Oxonium- und hydroxid-Ionen abfangen, ohne dass es zu größeren Veränderungen des pH-Wertes kommt.?
In welchen Ph_bereichen ist dieser Effekt am deutlichsten?
3 Antworten
Die Frage ist: Können sie das wirklich? die Antwort hängt davon ab, welchen pH-Bereich (und welche Aminosäure Du betrachtest).
Nehmen wir mal Glycin. Das hat die beiden Säurekonstanten 2.35 und 9.6. Es ist also eine zweibasige Säure:
NH₃⁺–CH₂–COOH + H₂O ⟶ H₃O⁺ + NH₃⁺–CH₂–CO₂⁻
NH₃⁺–CH₂–CO₂⁻ + H₂O ⟶ H₃O⁺ + NH₂–CH₂–CO₂⁻
Die Säureform NH₃⁺–CH₂–COOH ist sowohl an der Amino- als auch an der Carboxylgruppe protoniert. In der ersten Dissoziationsstufe wird das Carboyl-H abgegeben, und es entsteht das amphotere Zwitterion NH₃⁺–CH₂–CO₂⁻. In der zweiten Dissoziationsstufe, die ziemlich schwach ist (etwa wie NH₄⁺) wird dann die Aminogruppe deprotoniert, und es entsteht das Anion NH₂–CH₂–CO₂⁻.
Eine Lösung von Glycin in Wasser hat einen pH≈½(pK₁+pK₂)≈6, was ungefähr dem pH im Körper entspricht. Bei diesem pH-Wert ist die Pufferwirkung minimal, der pH wird also nicht stabilisiert:
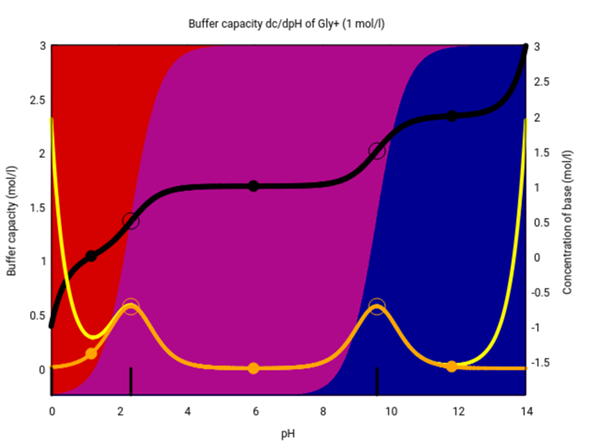
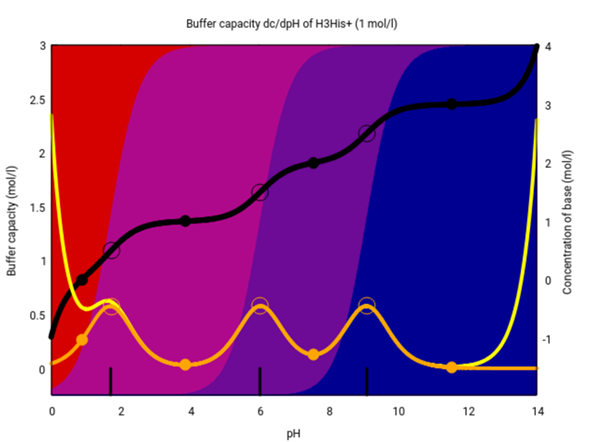
Die Graphik ist kompliziert. Auf der x-Achse ist der pH aufgetragen. Die linke y-Achse bezieht sich auf die gelbe/orange Kurve und gibt die Pufferkapazität an (orange ist der Anteil, der nur vom Glycin kommt, die gelbe Kurve berücksichtigt auch noch andere Ionen bei eher extremen pH-Werten). Die schwarze Kurve zeigt, wieviel Base (oder wenn negativ, Säure) Du zugeben mußt, um den pH auf den gewünschten Wert zu verschieben (Ausgangspunkt ist das Kation). Die Hintergrundfarben geben die Zusammensetzung der Lösung an; rund um den Neutralpunkt dominiert das Zwitterion (violett).
Du siehst, daß die Pufferkapazität am höchsten rund um die beiden pKₐ-Werte ist (so wie das immer der Fall ist), aber im annähernd Neutralen puffert die Lösung gar nicht.
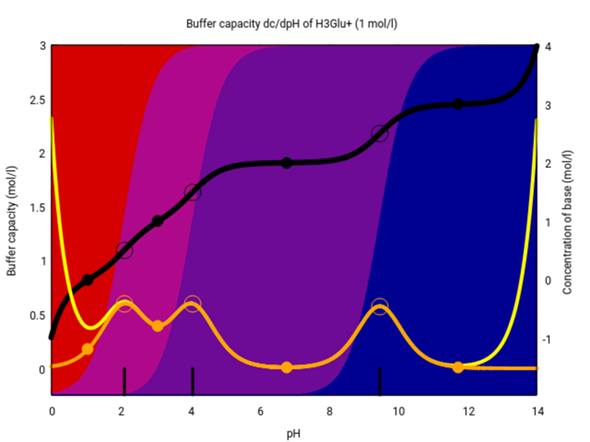
Bei anderen Aminosäuren kann das etwas anders aussehen, als Beispiel die Glutaminsäure. Die hat zwei COOH-Gruppen und eine NH₂-Gruppe, also gibt es insgesamt drei Dissoztionsgleichgewichte und vier Spezies, in vier Farben (Monokation H₃Glu⁺ bis Dianion Glu²⁻). Wegen der beiden sauren COOH-Gruppen mit pKₐ-Werten von 2.1 und 4.1 gibt es ein breites Puffergebiet im Sauren, aber wieder keine ordentliche Pufferwirkung im Neutralen:
Aber es gibt auch noch basische Aminosäuren. Lysin und Arginin bringen nichts (weil der pKₐ-Wert der Seitengruppe irgendwo jenseits von 10 liegt), aber Histidin hat die pKₐ-Werte 1.82, 6.0 und 9.17, das gibt einen Puffer im ungefähr Neutralen:
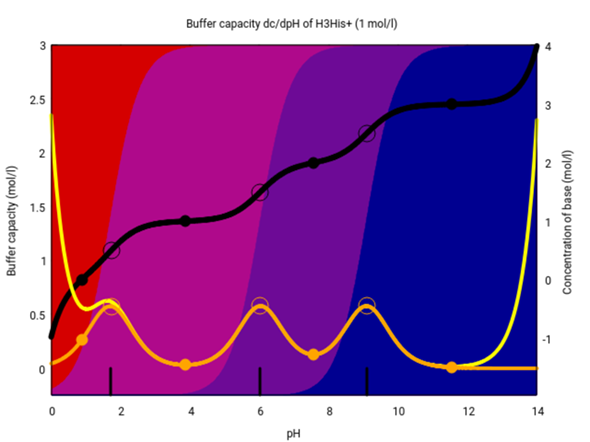
Also ist Histidin die einzige Aminosäure, die bei pH-Werten, wie man sie typischerweise in einer Zelle findet, als Puffer wirksam ist.
Nebenbei gesagt, ist an dieser Erkenntnis absolut nicht Besonderes. Alle Säuren puffern in der Nähe ihres pKₐ-Wertes, und die Aminosäuren haben als mehrwertige Säuren eben mehrere davon. Im Prinzip verhalten sie sich ganz gleich wie andere mehrbasige Säuren, z.B. Oxalsäure oder Phosphorsäure bzw. deren Anionen.

Am jeweiligen "isoelektrischen Punkt" dürften Aminosäuren am besten "puffern" - hier reagieren sie ja gleichstark auf Wassser als Säure und Wasser als Base.
Die Pufferwirkung ist am besten in den pH-Bereichen, die möglichst nahe bei den pKs-Werten der funktionellen Gruppen liegen.