Wodurch kommt der PH Sprung von mehr als 6 Einheiten bei der Titration nach der Zugabe von nur einem Tropfen der Maßlösung?
4 Antworten
Beispiel starke Säure mit starker Base titriert.
Um von pH = 4 auf pH=7 zu kommen, musst Du nur 10^(-4) mol/l Säure neutralisieren, brauchst also 10^(-4) mol/l Base.
Um von pH = 7 auf pH=10 (also pOH = 4) zu kommen, brauchst Du weitere 10^(-4) mol/l Base.
Bei laborüblichen Mengen und Konzentrationen also 0,01 ml bis 0,2 ml Base für den pH-Sprung von 6 Einheiten.
Stell Dir vor, Du hast 50 ml reines Wasser (pH=7) im Titrierkolben. Jetzt gibst Du einen Tropfen, also ca. 0.05 ml, einer 1 mol/l HCl dazu. Wie groß ist der pH-Wert? Das kann man leicht ausrechnen: Die Stoffmenge HCl in dem Tropfen ist 0.00005 mol, also hast Du eine 0.000005 mol / 0.05 l = 0.001 mol/l HCl, also pH=3.
Das ist ein Sprung um vier pH-Einheiten mit einem Tropfen HCl.
Nun nehmen wir an, daß wir NaOH mit HCl titrieren. Am Anfang passiert nicht viel, weil die im Überschuß vorhandenen OH⁻-Ionen die zugetropften H₃O⁺ „fressen“. Aber sobald die OH⁻ fast vollständig aufgebraucht sind, passiert dasselbe wie beim Wasser: Die H₃O⁺-Ionen können sich ungestört ausbreiten, und drücken den pH-Wert der Lösung enorm. Sogar noch mehr als beim reinen Wasser, weil wir ja mit einer basiischen Lösung gestartet sind.
Die angehängte Titrationskurve (10 ml NaOH 1 mol/l, verdünnt auf 50 ml im Titrationskolben, titriert mit 1 mol/l HCl) zeigt das Verhalten. Der Äquivalenzpunkt liegt bei 10 ml, und mit dem einen einzgen Tropfen zwischen 9.975 und 10.025 ml Verbrauch springt der pH um 7.24 Einheiten. Am Äquvalenzpunkt selber ist die Steigung noch viel größer, nämlich 631 pH-Einheiten pro Tropfen.
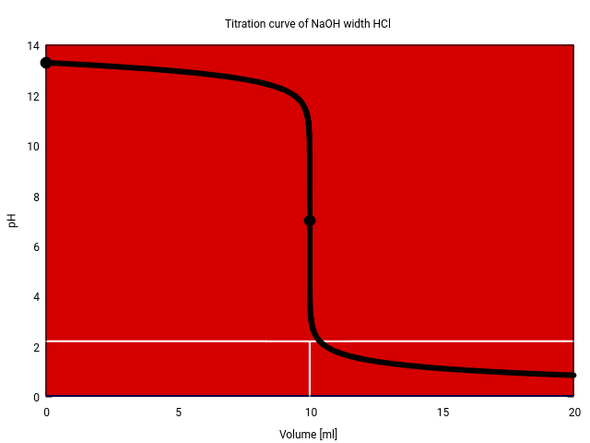
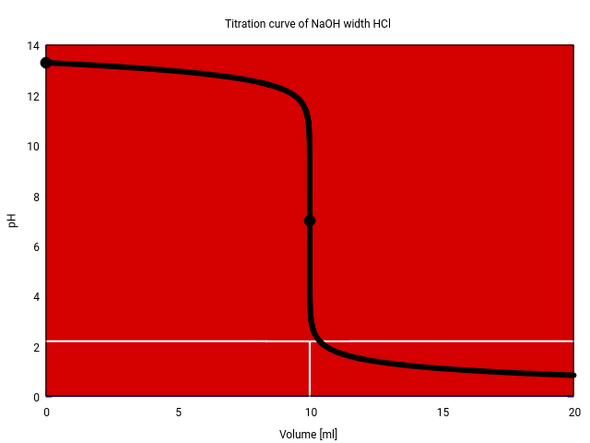
Du brauchst 100 Tropfen, um von pH 12 auf pH 11 zu kommen, mit weiteren 10 bist du bei pH 10, noch einer und pH 9 ist erreicht. Jetzt noch ein Tropfen und du bist bei pH 3.
Reicht auch für SBV 4,3.
das liegt daran, dass der ph wert eine logarithmische größe ist
Meine Schätzung ergibt pH=4 mit dem letzten Tropfen.